
来源:科学网
近日,西北农林科技大学化学与药学院教授谢卫青团队在过渡金属不对称催化领域取得重要突破,相关研究成果在线发表ACS Catalysis上。该研究首次报道了铱催化的不对称串联氮杂环丙烷化/氮杂半频哪醇重排反应,成功实现了含季碳立体中心的双环内酰胺类化合物的高效、高对映选择性合成。通过手性配体的精准调控,该反应展现出优异的立体控制能力,为复杂天然产物及药物分子的结构修饰与合成提供了新策略。
氮杂半频哪醇重排反应(Aza-semipinacol rearrangement)通过氮β-位碳正离子的形成及随后的α-位取代基1,2-迁移过程,已成为构建季碳立体中心的重要策略。然而,该反应的不对称催化研究仍处于起步阶段,相关报道极为有限。近年来,金属氮宾化学的发展为这一领域注入了新的活力。例如,铑催化的苯乙烯基叠氮环异构化反应虽取得一定进展,但仍存在底物范围狭窄、对映选择性控制尚未实现等显著局限性。在此背景下,如何发展高效的手性催化体系,实现氮杂半频哪醇重排反应的立体选择性调控,特别是用于构建含季碳中心的手性双环骨架,仍是当前有机合成领域亟待解决的关键科学难题。
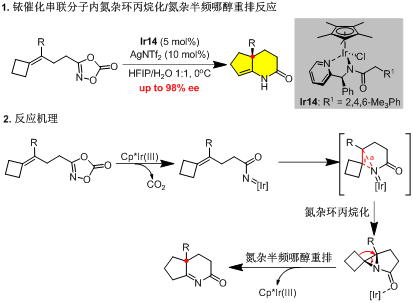 铱催化1,4,2-二恶唑-5-酮不对称串联分子内氮杂环丙烷化/氮杂半频哪醇重排反应及机理。西北农林科技大学供图
铱催化1,4,2-二恶唑-5-酮不对称串联分子内氮杂环丙烷化/氮杂半频哪醇重排反应及机理。西北农林科技大学供图该课题组发展了Cp*Ir(III)催化烯基1,4,2-二恶唑-5-酮的不对称串联分子内氮杂环丙烷化/氮杂半频哪醇重排反应,以易制备的烯基二恶唑酮为原料,高效构建含季碳立体中心的双环氮杂环骨架。经系统筛选发现,2,4,6-三甲基苯基乙酰基修饰的手性苯基(吡啶-2-基)甲胺配体可诱导最优的对映选择性(高达98% ee),为环戊[b]吡啶-2-酮类化合物的精准合成提供了普适性方案。机理研究表明,该反应经历Ir-酰基氮烯中间体形成、分子内氮杂环丙烷化及随后的氮杂半频哪醇重排三个关键步骤,DFT计算为这一反应路径提供了理论支持。
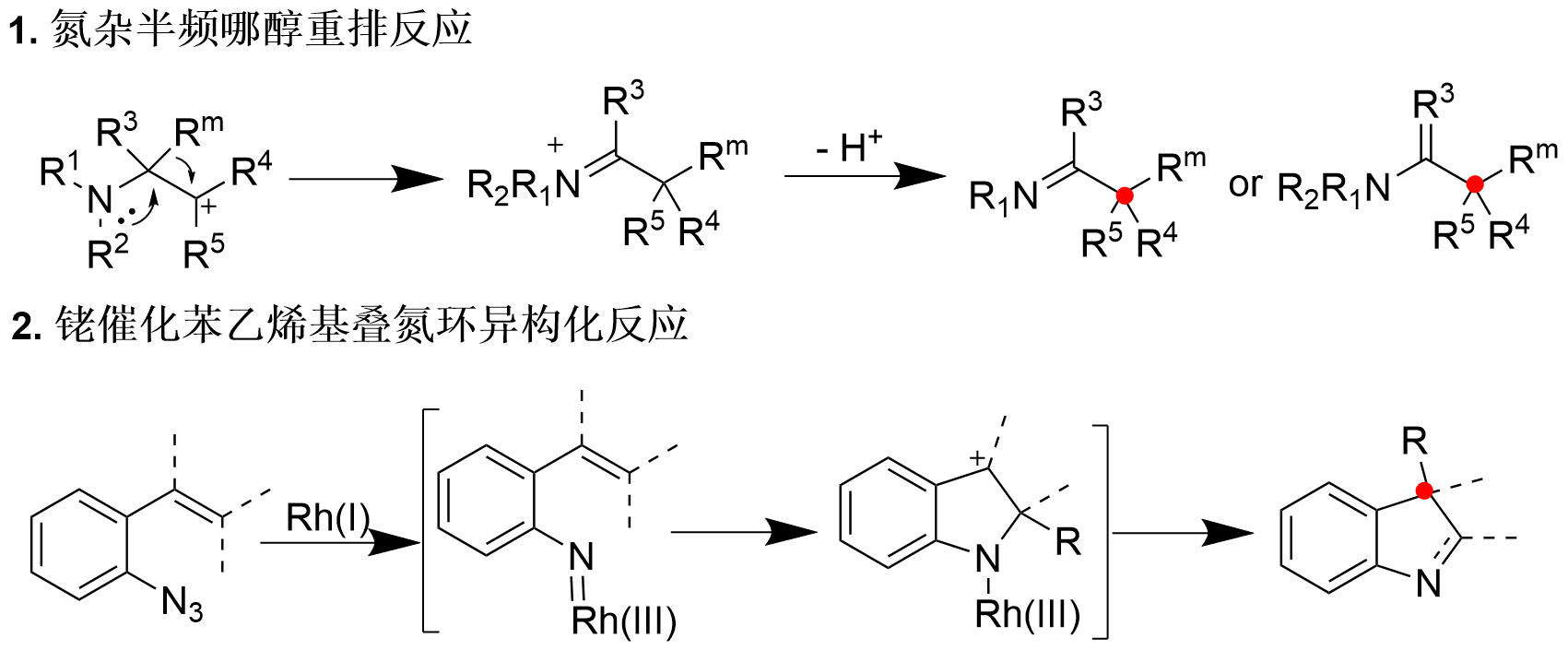
氮杂半频哪醇重排和过渡金属催化的串联环化/氮杂半频哪醇重排反应。西北农林科技大学供图